
Testiranje stabilnosti zdravil je postopek določanja roka uporabnosti farmacevtskih izdelkov. Vključuje preizkušanje zdravila v različnih okoljskih pogojih, kot so temperatura, vlažnost in svetloba, za oceno reakcije zdravila skozi čas. Rezultati testiranja se uporabljajo za določitev garancijske dobe zdravila.
Model: TG-500GSP
Kapaciteta: 500L
Polica: 4 kos
Barva: Umazano bela
Notranja mera: 670×725×1020 mm
Zunanja dimenzija: 850×1100×1930 mm
Opis
Testiranje stabilnosti zdravil je vrsta klimatske komore, ki se uporablja za testiranje stabilnosti farmacevtskih izdelkov. Zasnovan je tako, da simulira okoljske razmere, ki so jim zdravila lahko izpostavljena med shranjevanjem in transportom. Smernice ICH zagotavljajo smernice o zasnovi in delovanju komore za testiranje stabilnosti zdravila ter testne protokole, ki jih je treba uporabiti.
Specifikacija
|
Model |
TG-150GSP |
TG-250GSP |
TG-500GSP |
TG-800GSP |
TG-1000GSP |
|
Notranja dimenzija (Š*G*V) |
550×405×670 |
600×500×830 |
670×725×1020 |
800×590×1650 |
1050×590×1650 |
|
Zunanje dimenzije (Š*G*V) |
690×805×1530 |
740×890×1680 |
850×1100×1930 |
1360×890×2000 |
1610×890×2000 |
|
Zmogljivost |
150L |
250L |
500L |
800L |
1000L |
|
Temperaturno območje |
Brez svetlobe 0~65°C, s svetlobo 15~50°C |
||||
|
Temperaturno nihanje: ±0,5°C; Enakomernost temperature: ±2,0°C |
|||||
|
Razpon vlažnosti |
35 % ~ 95 % R.H |
||||
|
Odstopanje vlažnosti |
±3,0 % R.H |
||||
|
Razsvetljava |
0~6000LX nastavljiv ≤±500LX (Neomejeno prilagajanje jakosti svetlobe) |
||||
|
Nadzor temperature |
Metoda uravnotežene nastavitve temperature |
||||
|
Nadzor vlažnosti |
Metoda uravnotežene nastavitve vlažnosti |
||||
|
Hlajenje |
Samodejni preklop dveh neodvisnih originalnih uvoženih hermetičnih kompresorjev (LHH-80SD: en komplet) |
||||
|
Notranji material |
Protikorozijsko brušeno nerjaveče jeklo SUS#304 |
||||
|
Zunanji material |
Hladno valjana jeklena plošča z elektrostatičnim brizganjem prahu |
||||
|
Izolacija |
Superfina volna iz steklenih vlaken / poliuretan |
||||
|
Krmilnik |
Programabilni LCD krmilnik |
||||
|
Senzor |
PT100 platinasti upor / kapacitivni senzor vlage |
||||
|
Police |
3 KOSOV |
3 KOSOV |
4 KOSOV |
||
|
Poraba energije |
2100 W |
2300 W |
3750 W |
7150 W |
7150 W |
|
Napajanje |
220V/50HZ |
380V/50HZ |
|||
|
Vstavite MIni tiskalnik |
1 komplet |
||||
|
Zaščitne naprave |
Zaščita pred pregrevanjem kompresorja, zaščita pred pregrevanjem ventilatorja, zaščita pred previsoko temperaturo, zaščita pred nadtlakom kompresorja, zaščita pred preobremenitvijo, zaščita proti pomanjkanju vode. |
||||
|
Delovni pogoj |
+5~30℃ |
||||
Varnostna zaščita:
·Neodvisni omejevalnik temperature: neodvisen izklop in alarm za namen toplotne zaščite med preskusom.
· Hladilni sistem: Zaščita kompresorja pred pregrevanjem, previsokim tokom in nadtlakom.
· Preskusna komora: zaščita pred previsoko temperaturo, pregrevanje ventilatorja in motorja, izpad/obrat faze, časovna nastavitev celotne opreme.
· Drugo: Zaščita pred uhajanjem in izpadom, zaščita pred preobremenitvijo, alarm z zvočnim signalom, zaščita pred uhajanjem električne energije in zaščita pred preobremenitvijo.
Krivulja temperature in vlažnosti:
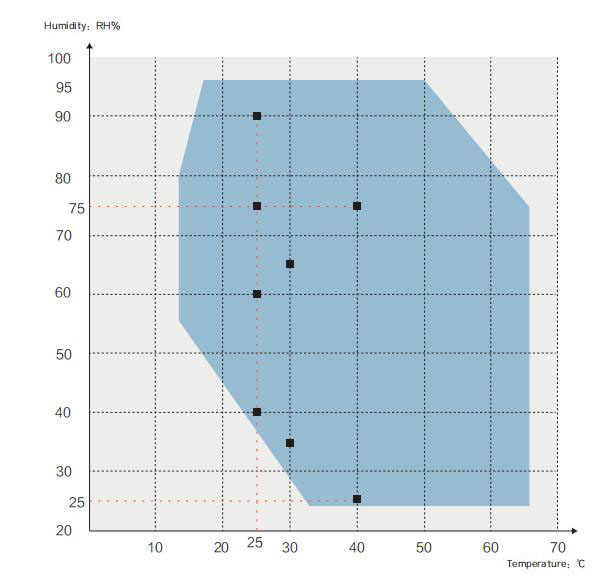
■Farmakopejske smernice o stabilnosti zdravil in pripravkov ter
preskusni pogoji temperature in vlažnosti, zahtevani v smernicah ICH:
Temperatura okolja za naslednje preskuse mora biti med 15 ~ 25 ℃
√ Pospešeni test: 40℃±2℃ / 75%±5%RH ali 30℃±2℃/65%±5%RH
√Preskus visoke vlažnosti: 25℃ / 90%±5%RH ali 25℃/75%±5%RH
√ Dolgoročni test: 25 ℃ ± 2 ℃ / 60 % ± 5 % RH ali 30 ℃ ± 2 ℃ / 65 % ± 5 % RH
√Za pospešeno testiranje pripravkov zdravil pakiranih v polprepustno
posode, kot so infuzijske vrečke, ki jih je pripravil LDB, plastične ampule in očesne
posode za pripravo itd., preskusi se izvajajo pri temperaturi 40 ℃ ± 2 ℃/25 % ± 5 % RH
√Za dolgoročno testiranje farmacevtskih pripravkov pakiranih v pol
prepustne posode, mora biti pri temperaturi 25 ℃ ± 2 ℃/40 % ± 5 % RH ali 30 ℃ ± 2 ℃/35 % ± 5 % RH
Funkcija
Katere so glavne značilnosti testiranja stabilnosti zdravila?
Naslednje vam lahko pomaga bolje razumeti to dvorano:
1. Nadzor temperature: Preizkušanje stabilnosti zdravila lahko vzdržuje natančen nadzor temperature, temperaturno območje je lahko od -20 °C do 70 °C.
2. Nadzor vlažnosti: raven vlažnosti znotraj stabilnostnih farmacevtskih komor je mogoče nastaviti tako, da simulira različno vlažnost. To je še posebej pomembno za zdravila, občutljiva na vlago, kot so nekatere vrste trdnih oblik doziranja in bioloških zdravil.
•Programabilni krmilnik zaslona na dotik
. 100 programov, 1000 segmentov 999 korakov, 99 ur 59 minut za vsak segment.
. Funkcija samodejnega izračuna P.I.D.
. RS485 komunikacijski vmesnik / na voljo vgrajen tiskalnik za shranjevanje podatkov in predvajanje zgodovinske krivulje.
. Snemanje podatkov in prikaz diagnoze napak, ko pride do napake, bo vzrok napake dinamično prikazan na krmilniku.

3. Nadzor osvetlitve: nekatera zdravila so občutljiva na svetlobo in se lahko razgradijo, če so izpostavljena določenim valovnim dolžinam svetlobe. Zato ima komora za testiranje stabilnosti zdravila Climatest Symor® nadzor osvetlitve, kot je UV-svetloba, za ugotavljanje učinka svetlobe na zdravilo.
4. Kroženje zraka: Preskušanje stabilnosti zdravila ima sisteme kroženja zraka za vzdrževanje dosledne in enakomerne temperature in vlažnosti po vsej komori.
5. Beleženje in spremljanje podatkov: Testiranje stabilnosti zdravila je opremljeno s senzorji in sistemi za beleženje podatkov, ki spremljajo in beležijo temperaturo, vlažnost in druge okoljske parametre, ki se lahko uporabijo za ustvarjanje poročil in potrjevanje stabilnosti izdelka.
Na splošno je komora za testiranje stabilnosti zasnovana tako, da zagotavlja, da so zdravila shranjena in testirana v nadzorovanih okoljskih pogojih, ki simulirajo pogoje v resničnem svetu, ter zagotavlja natančne in zanesljive podatke o stabilnosti za regulativno odobritev.
Območje testiranja:
Testno območje komore za testiranje farmacevtske stabilnosti je izdelano iz brušenega nerjavečega jekla SUS304 in je zasnovano za simulacijo stalne temperature, vlažnosti ali svetlobnih pogojev. Komora je opremljena z visoko natančnimi senzorji temperature in vlažnosti za spremljanje in vzdrževanje teh podnebnih razmer.
Obstajajo stojala ali police za shranjevanje vzorcev zdravil, te police so nastavljive po višini, vzorci pa so običajno postavljeni v tesno zaprte steklene viale ali posode, da se prepreči kontaminacija.

Prednosti, ki jih ponuja testiranje stabilnosti zdravil
Testiranje stabilnosti zdravil proizvajalcem farmacevtskih izdelkov ponuja številne prednosti, vključno z:
. Zagotavljanje kakovosti izdelkov: Stabilnostna komora v farmaciji pomaga farmacevtskim podjetjem pri testiranju in preučevanju kakovosti njihovih izdelkov, kar je ključnega pomena za zagotavljanje, da ostanejo varni in učinkoviti v celotnem roku uporabnosti.
. Izpolnjevanje regulativnih zahtev: Testiranje stabilnosti je kritičen del regulatornega postopka odobritve farmacevtskih izdelkov, stabilnostna komora v farmaciji pa je bistvena za izpolnjevanje regulativnih zahtev.
. Izboljšanje proizvodne učinkovitosti: Testiranje stabilnosti lahko zagotovi tudi dragocene podatke o roku uporabnosti novih formulacij izdelkov, ki lahko prispevajo k razvoju izdelkov in prizadevanjem za optimizacijo.
. Zmanjšanje odpadkov izdelka: Testiranje stabilnosti lahko pomaga prepoznati izdelke, pri katerih obstaja tveganje, da se pokvarijo ali postanejo nestabilni, kar lahko proizvajalcem pomaga prihraniti stroške izdelave.
Če povzamemo, testiranje stabilnosti zdravila pomaga zagotoviti kakovost izdelka, skladnost z regulativnimi zahtevami, stroškovno učinkovito testiranje, izboljšati razvoj izdelka in povečati produktivnost.
Vloga testiranja stabilnosti zdravila
Testiranje stabilnosti zdravil je zasnovano tako, da izpolnjuje stroge regulativne zahteve in industrijske standarde, kot so tisti, ki jih je določila Mednarodna konferenca o harmonizaciji (smernica ICH). Komore se lahko uporabljajo za različne namene, vključno z:
*Testiranje stabilnosti pri dolgotrajnem shranjevanju: Ta vrsta testiranja se uporablja za določanje stabilnosti zdravila v daljšem časovnem obdobju, običajno več let.
*Pospešeno testiranje stabilnosti: Ta vrsta testiranja se uporablja za oceno stabilnosti zdravila v težkih pogojih, kot so visoke temperature in vlaga, v kratkem času.
* Testiranje roka uporabnosti: Testiranje stabilnosti zdravila se uporablja za določitev roka uporabnosti zdravila, ki je čas, v katerem je izdelek mogoče shraniti pod določenimi pogoji, ne da bi pri tem izgubil moč, učinkovitost ali kakovost.
Na podlagi rezultatov testiranja stabilnosti lahko proizvajalec določi rok uporabnosti izdelka in naredi potrebne prilagoditve formulacije ali embalaže, da zagotovi, da izdelek ostane stabilen skozi čas. Ti podatki so ključnega pomena za regulativne agencije, ki jih uporabljajo za določanje ustreznih zahtev za shranjevanje in ravnanje z zdravili.

Pospešeno testiranje pri testiranju stabilnosti zdravila
Pospešeno testiranje se izvaja pod običajnimi pogoji, njegov namen pa je pospešiti kemične ali fizikalne spremembe zdravila za pregled, pakiranje, transport in dostavo zdravila. Spodaj je primer za prikaz pospešenih testnih postopkov:
Uporabni izdelki: surovine in farmacevtski pripravki
Serije: 3 serije, tržno pakiranje
Pogoji shranjevanja: 40℃±2℃; 75 % ± 5 %
Čas skladiščenja: 6 mesecev
Ocena: Po 6 mesecih odvzemite vzorce iz 1., 2. in 3. serije, jih pregledajte glede na uveljavljene standarde kakovosti, če ne ustrezajo standardu, nato testirajte @30°C±2°C, 65%+5 % za 6 mesecev.
Pričakuje se, da je temperaturno občutljiva zdravila shranjena v hladilniku (4~8°C). Pospešeni preskus se lahko izvede pri 25 °C±2 °C; 60%±10%, 6 mesecev.
Potrdila o testiranju stabilnosti zdravil Climatest Symor®
Certifikati so uradni dokumenti, ki jih izdajo proizvajalci ali akreditirajo tretje organizacije, potrjujejo delovanje in skladnost komore z ustreznimi predpisi in standardi. Climatest Symor® ima certifikat ISO9001:2015, vse komore za testiranje stabilnosti so odobrene s CE.

Slike namestitve na mestu
Namestitev testa stabilnosti zdravila zahteva skrbno načrtovanje in pozornost do podrobnosti, da se zagotovi pravilna namestitev
